
Inhoudsopgave:
- Auteur Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:39.
- Laatst gewijzigd 2025-01-22 17:06.
De verschil tussen een ionisch en een covalente binding is dat een covalente binding ontstaat wanneer twee atomen elektronen delen. Ionische bindingen zijn krachten die elektrostatische krachten bij elkaar houden van aantrekkingen tussen tegengesteld geladen ionen . Ionische bindingen een elektronegativiteit hebben verschil groter dan of gelijk aan 2.
Zo, hoe verschilt een covalente binding van een ionische binding?
Een ionbinding wordt gevormd tussen een metaal en een niet-metaal. Covalente binding is een vorm van chemisch binding tussen twee niet-metalen atomen die wordt gekenmerkt door het delen van elektronenparen tussen atomen en andere covalente bindingen.
Ten tweede, wat is een ionische binding en een covalente binding? Chemisch Bonding De twee extreme gevallen van chemicaliën obligaties zijn: Covalente binding : verbintenis waarin een of meer elektronenparen worden gedeeld door twee atomen. Ionbinding : verbintenis waarbij een of meer elektronen van het ene atoom worden verwijderd en aan een ander atoom worden gehecht, wat resulteert in positieve en negatieve ionen die elkaar aantrekken.
Ten tweede, wat is een covalente binding een quizlet met ionische bindingen?
Ionische bindingen . formulier ionen , winnen of verliezen buitenste schilelektronen, vul buitenste elektronenschil. Covalente bindingen . vormen moleculen, delen buitenste schilelektronen, vullen buitenste elektronenschil.
Wat zijn enkele voorbeelden van ionbindingen?
Voorbeelden van ionische bindingen zijn:
- LiF - Lithiumfluoride.
- LiCl - Lithiumchloride.
- LiBr - Lithiumbromide.
- LiI - Lithiumjodide.
- NaF - Natriumfluoride.
- NaCl - Natriumchloride.
- NaBr - Natriumbromide.
- NaI - Natriumjodide.
Aanbevolen:
Hoe verschilt de vorm van een plantencel van die van een dierlijke cel?
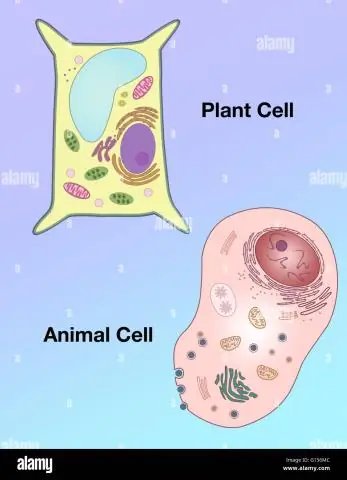
Vacuolen: Plantencellen hebben een grote vacuole, terwijl dierlijke cellen meerdere kleine vacuolen bevatten. Vorm: Plantencellen hebben een meer regelmatige vorm (meestal rechthoekig), terwijl dierlijke cellen onregelmatige vormen hebben. Lysosomen: zijn over het algemeen aanwezig in dierlijke cellen, terwijl ze afwezig zijn in plantencellen
Hoe verschilt een kristal van aluin van een kristal van kaliumaluminiumsulfaat?

A) Het antwoord is: kaliumaluminiumsulfaat is kristal met kubische structuur, kaliumaluminiumsulfaatdodecahydraat (aluin) is hydraat (bevat water of de samenstellende elementen ervan)
Hoe vind je het aantal covalente bindingen in een verbinding?

Het aantal bindingen voor een neutraal atoom is gelijk aan het aantal elektronen in de volledige valentieschil (2 of 8 elektronen) minus het aantal valentie-elektronen. Deze methode werkt omdat elke covalente binding die een atoom vormt een ander elektron toevoegt aan een valentieschil van een atoom zonder de lading ervan te veranderen
Waarin verschilt de levenscyclus van een varen van de levenscyclus van een mos?

Verschillen: -- Mossen zijn niet-vasculaire planten; varens zijn vasculair. -- Gametofyt is de dominante generatie in mossen; sporofyt is dominante generatie in varens. -- Mossen hebben aparte mannelijke en vrouwelijke gametofyten; varen gametofyten hebben mannelijke en vrouwelijke delen op dezelfde plant
Vormen pyrimidinen covalente bindingen met purines?

Pyrimidinen vormen covalente bindingen met purines. Adenine en Guanine zijn pyrimidines 2.)
