
- Auteur Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:39.
- Laatst gewijzigd 2025-01-22 17:06.
De waterstofbruggen in water laat het toe absorberen en warmte afgeven energie langzamer dan veel andere stoffen. Temperatuur is een maat voor de beweging (kinetische energie ) van moleculen . Naarmate de beweging toeneemt, energie hoger is en dus de temperatuur hoger.
Evenzo, waarom vormen zich waterstofbruggen tussen watermoleculen?
Waterstof - bindingsvormen in vloeistof water als de waterstof atomen van één water molecuul worden aangetrokken door het zuurstofatoom van een naburige water molecuul ; in het algemeen een proton gedeeld door twee eenzame elektronenparen. Deze attractie is de basis van de ' waterstof ' obligaties.
Vervolgens is de vraag, hoeveel energie kost het om de bindingen tussen watermoleculen te verbreken? Het gemiddelde bindingsenergie van O-H in H2O is 464 kJ/mol. Dit komt doordat de H-OH verbintenis heeft 498,7 kJ/mol nodig om te dissociëren, terwijl de O-H verbintenis heeft 428 kJ/mol nodig. Wanneer meer verbintenis energieën van de verbintenis onverschillig moleculen in aanmerking worden genomen, zal het gemiddelde nauwkeuriger zijn.
De vraag is ook, waarom is water zo effectief bij waterstofbinding?
Deze attractie gemaakt door waterstofbinding houdt water in een vloeibare fase over een breed temperatuurbereik. De energie die nodig is om de waterstofbruggen oorzaken water een hoge verdampingswarmte hebben; dus dat het een grote hoeveelheid energie kost om vloeistof om te zetten water in de gasfase, water damp.
Waarom zijn waterstofbruggen belangrijk in water?
Waterstofbruggen in water bieden veel karakteristieke voordelen aan: water : cohesie (vasthouden) water moleculen samen), hoge soortelijke warmte (warmte absorberen bij breken, warmte afgeven bij vorming; minimaliseren van temperatuurverandering), hoge verdampingswarmte (meerdere waterstofbruggen moet worden gebroken om te verdampen water )
Aanbevolen:
Hoe bereken je het werkelijke vermogen en het schijnbare vermogen?
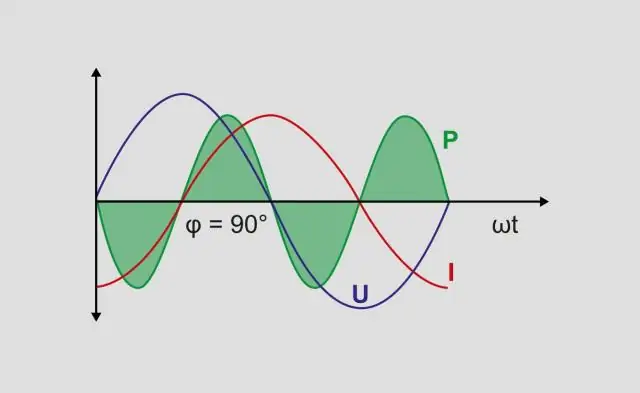
De combinatie van blindvermogen en werkelijk vermogen wordt schijnbaar vermogen genoemd en is het product van de spanning en stroom van een circuit, zonder verwijzing naar de fasehoek. Schijnbaar vermogen wordt gemeten in de eenheid Volt-Amps (VA) en wordt gesymboliseerd door de hoofdletter S
Hoe kan een model helpen bij het vinden van de waarschijnlijkheid van een samengestelde gebeurtenis?
Definitie van waarschijnlijkheid van samengestelde gebeurtenissen Een samengestelde gebeurtenis is een gebeurtenis waarbij er meer dan één mogelijke uitkomst is. Het bepalen van de waarschijnlijkheid van een samengestelde gebeurtenis omvat het vinden van de som van de kansen van de afzonderlijke gebeurtenissen en, indien nodig, het verwijderen van overlappende kansen
Welke kenmerken van metaalatomen helpen verklaren waarom valentie-elektronen in een metaal gedelokaliseerd zijn?

Een metaalbinding is het delen van veel losse elektronen tussen veel positieve ionen, waarbij de elektronen als een 'lijm' werken en de stof een definitieve structuur geven. Het is anders dan covalente of ionische binding. Metalen hebben een lage ionisatie-energie. Daarom kunnen de valentie-elektronen door de metalen worden gedelokaliseerd
Hoeveel water verdampt een boom?

Tijdens een groeiseizoen zal een blad vele malen meer water verdampen dan zijn eigen gewicht. Een hectare maïs geeft elke dag ongeveer 3.000-4.000 gallons (11.400-15.100 liter) water af, en een grote eik kan 151.000 liter per jaar verdampen
Welke eigenschap van water verklaart het beste het vermogen om een grote verscheidenheid aan materialen op te lossen?

Vanwege de polariteit en het vermogen om waterstofbruggen te vormen, is water een uitstekend oplosmiddel, wat betekent dat het veel verschillende soorten moleculen kan oplossen
