
- Auteur Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:39.
- Laatst gewijzigd 2025-01-22 17:06.
De enthalpie van formatie voor een element in zijn elementaire staat zal altijd zijn 0 omdat het geen energie kost om een natuurlijk voorkomende verbinding te vormen. Wanneer een stof is gevormd van de meest stabiele vorm van zijn elementen , een verandering in enthalpie vindt plaats.
Evenzo kan men zich afvragen, welke stoffen hebben een vormingsenthalpie van nul?
Alle elementen in hun standaardtoestanden (zuurstofgas, vast koolstof in de vorm van grafiet , enz.) hebben een standaard vormingsenthalpie van nul, omdat er geen verandering is in hun vorming.
Vervolgens is de vraag, wat is de enthalpie van de vorming van water? Geselecteerde ATcT-vormingsenthalpie op basis van versie 1.118 van het Thermochemical Network
| Soortnaam: | Formule | ΔFH°(298.15 K) |
|---|---|---|
| Water | H2O (cr, eq.pers.) | -292.740 |
Dienovereenkomstig, waarom is de standaard enthalpie van de vorming van diamant niet nul, hoewel het een element is?
De standaard vormingsenthalpie voor een element in zijn standaard - staat is NUL !!!! Dus, ΔH°f voor C (s, grafiet) is nul , maar de ΔH°f voor C (s, diamant ) is 2 kJ/mol. Dat komt omdat grafiet de standaard - staat voor koolstof, geen diamant.
Wat betekent het als Delta h nul is?
Ze kunnen alleen veranderingen in enthalpie meten. Wanneer enthalpie positief is en delta H is groter dan nul , dit middelen dat een systeem warmte opneemt. Dit wordt een endotherme reactie genoemd. Wanneer enthalpie negatief is en delta H is minder dan nul , dit middelen dat een systeem warmte afgeeft. Dit wordt een exotherme reactie genoemd.
Aanbevolen:
Waarom is de EMF nul wanneer de spoel door het exacte midden van de magneet gaat?
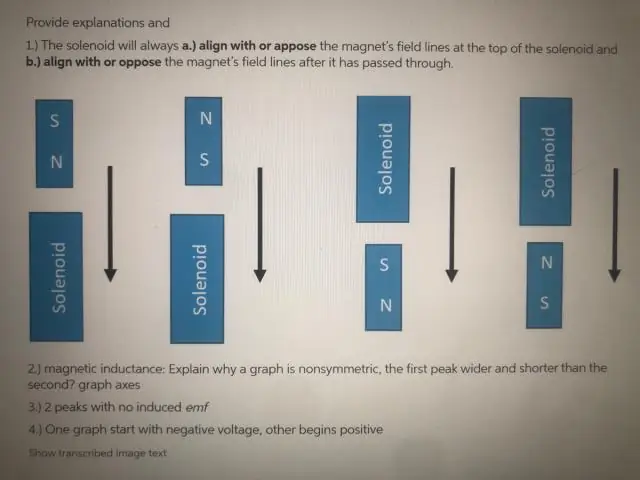
De emf is slechts even nul als de magneet door het exacte midden van de spoel gaat. Dit komt omdat het effect van de N-pool aan het ene uiteinde van de magneet op dat uiteinde van de spoel, precies teniet wordt gedaan door het effect van de S-pool van de magneet aan het andere uiteinde van de spoel
Wat is de standaard vormingsenthalpie voor zwaveldioxide?

Om dit te controleren, moet het (&min;296.81±0.20) kJ/mol zijn. U moet NIST vaker gebruiken. Ik kreeg echter &min;310,17 kJ/mol. U moet eerst ΔH∘f voor SO3(g) opzoeken
Wat is de vormingsenthalpie van Cao?

Tabel met vormingswarmten Verbinding ΔHf (kJ/mol) CaCO3 -1207,0 CaO(s) -635,5 Ca(OH)2(s) -986,6 CaSO4(s) -1432,7
Hoe verhoudt de overvloed aan elementen op aarde zich tot de overvloed aan elementen in de mens?

Zuurstof is het meest voorkomende element, zowel op aarde als in de mens. De overvloed aan elementen die organische verbindingen vormen, neemt bij mensen toe, terwijl de overvloed aan metalloïden op aarde toeneemt. De elementen die overvloedig aanwezig zijn op aarde zijn essentieel om het leven in stand te houden
Zijn atomen gemaakt van elementen of zijn elementen gemaakt van atomen?

Atomen bestaan altijd uit elementen. Atomen zijn soms gemaakt van elementen. Ze hebben allemaal twee letters in hun atomaire symbolen. Ze hebben hetzelfde massagetal
