- Auteur Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:39.
- Laatst gewijzigd 2025-01-22 17:06.
Dus, terwijl je beweegt een groep neerhalen op het periodiek systeem, de elektronegativiteit van een element neemt af omdat het toegenomen aantal energieniveaus de buitenste elektronen erg ver van de aantrekkingskracht van de kern plaatst. Elektronegativiteit neemt toe naarmate u van links naar rechts over een periode in het periodiek systeem beweegt.
Wat dit betreft, waarom neemt de elektronegativiteit over een groep af?
Elektronegativiteit . Naar beneden gaan in a groep , de elektronegativiteit neemt af vanwege de grotere afstand tussen de kern en de valentie-elektronenschil, waardoor de aantrekkingskracht afneemt, waardoor het atoom minder aantrekkingskracht heeft op elektronen of protonen.
Vervolgens is de vraag: heeft elektronegativiteit een trend? Hoe hoger de elektronegativiteit van een atoom, hoe groter het vermogen om gedeelde elektronen aan te trekken. De elektronegativiteit Het aantal atomen neemt toe naarmate je van links naar rechts beweegt over een periode in het periodiek systeem. De elektronegativiteit van atomen neemt af naarmate u van boven naar beneden een groep in het periodiek systeem beweegt.
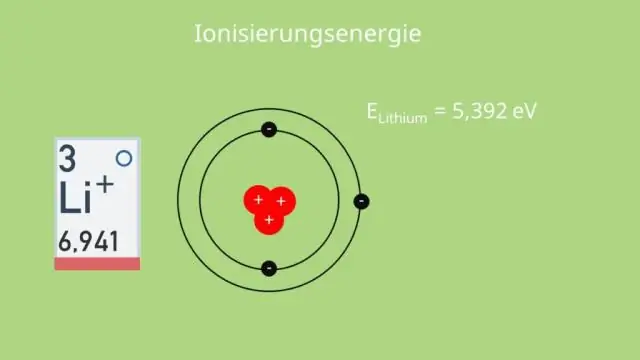
Je kunt je ook afvragen: wat is de trend in ionisatie-energie die naar beneden gaat in een groep?
Bewegend van links naar rechts over een periode, neemt de atoomstraal af, dus elektronen worden meer aangetrokken door de (dichtere) kern. De algemene trend is voor ionisatieenergie om het verplaatsen van boven naar beneden te verminderen omlaag een periodiek systeem groep . In beweging een groep naar beneden halen , wordt een valentieschaal toegevoegd.
Wat is de trend in atoomnummer dat naar beneden gaat in een groep?
- De nummer van energieniveaus neemt toe naarmate je beweegt een groep neerhalen als de nummer van elektronen neemt toe. Elk volgend energieniveau is verder van de kern dan het vorige. Daarom, de atomair straal neemt toe naarmate de groep en het energieniveau stijgt. 2) Naarmate u door een periode beweegt, atomair straal neemt af.
Aanbevolen:
Waarom hebben halogenen een hoge elektronegativiteit?

Door hun hoge effectieve kernlading zijn halogenen zeer elektronegatief. Daarom zijn ze zeer reactief en kunnen ze een elektron krijgen door reactie met andere elementen. Halogenen kunnen in voldoende hoeveelheden schadelijk of dodelijk zijn voor biologische organismen
Wat is de periodieke trend voor atoomgrootte van boven naar beneden in een groep?
Van boven naar beneden in een groep neemt de elektronegativiteit af. Dit komt omdat het atoomnummer in een groep toeneemt, en er dus een grotere afstand is tussen de valentie-elektronen en de kern, of een grotere atoomstraal
Wat is het verschil tussen een groep en een periode?

Punten zijn horizontale rijen (over) het periodiek systeem, terwijl groepen verticale kolommen (onder) de tabel zijn. Atoomgetal neemt toe naarmate u een groep naar beneden gaat of over een periode heen gaat
Wat is de elektronegativiteit van h2o?

Water, een polaire binding Waterstof heeft een elektronegativiteit van 2,0, terwijl zuurstof een elektronegativiteit van 3,5 heeft. Het verschil in elektronegativiteiten is 1,5, wat betekent dat water een polair covalent molecuul is
Wat is een voorbeeld van een periodieke trend?

Belangrijke periodieke trends zijn onder meer: elektronegativiteit, ionisatie-energie, elektronenaffiniteit, atomaire straal, smeltpunt en metaalkarakter. Periodieke trends, die voortkomen uit de opstelling van het periodiek systeem, bieden scheikundigen een hulpmiddel van onschatbare waarde om snel de eigenschappen van een element te voorspellen
