
- Auteur Miles Stephen [email protected].
- Public 2023-12-15 23:39.
- Laatst gewijzigd 2025-01-22 17:06.
Massa van Cu in gram kan worden verkregen door de te vermenigvuldigen massa - in amu met het nummer van Avogadro. Daarom, de massa van 3,5 mol van Cu is 3,69 × 10−22 gram 3,69 × 10 − 22 gram.
Wat is de massa van een mol koper?
De relatie tussen moleculaire (formule) massa - en kies massa - Page 4 4 • Om er een te krijgen mol koper atomen (6,02 x 1023 atomen), weeg 63,55 g koper . de kies massa - (M) van een stof is de massa - van een wrat entiteiten (atomen, moleculen of formule-eenheden) van de stof.
Wat is naast bovenstaande de massa in gram van 3,2 mol koper Cu? 203,36 gram
Hoeveel gram zit er dan in 3,35 mol koper?
1 wrat is gelijk aan 1 mol Koper , of 63.546 gram.
Hoeveel mol gaat er in een gram?
We gaan ervan uit dat u converteert tussen mollen In en gram . U kunt meer details over elke meeteenheid bekijken: molecuulgewicht van In of gram De SI-basiseenheid voor de hoeveelheid stof is de wrat . 1 wrat is gelijk aan 1 mollen In, of 114.818 gram.
Aanbevolen:
Wat is de verhouding van mol water tot mol CuSO4?

Deel het aantal mol verloren water door het aantal mol watervrij zout om de verhouding van watermoleculen tot formule-eenheden te krijgen. In ons voorbeeld is 0,5 mol water ÷ 0,1 mol kopersulfaat = 5:1 verhouding. Dit betekent dat we voor elke aanwezige eenheid CuSO4 5 moleculen water hebben
Hoeveel atomen zitten er in 1 mol koper?

Concept 2. De relatie tussen moleculaire (formule) massa en molaire massa • Om één mol koperatomen te verkrijgen (6,02 x 1023 atomen), weeg 63,55 g koper af. De molaire massa (M) van een stof is de massa van één mol entiteiten (atomen, moleculen of formule-eenheden) van de stof
Wat is een mol koper?

Uit uw periodiek systeem leren we dat één mol koper, 6,022 x 1023 individuele koperatomen een massa hebben van 63,55 g. En dus gebruiken we de MASSA van een chemisch monster om het AANTAL atomen en moleculen te berekenen
Wat is het verschil tussen de massa van een proton en de massa van een elektron?
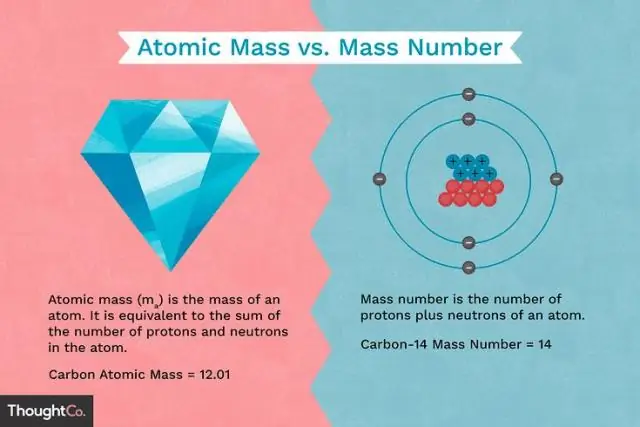
Protonen en neutronen hebben ongeveer dezelfde massa, maar ze zijn allebei veel massiever dan elektronen (ongeveer 2000 keer zo zwaar als een elektron). De positieve lading op een proton is even groot als de negatieve lading op een elektron
Hoe los je problemen met de massa van de massa van de reactanten op?

Vind het beperkende reagens door de hoeveelheid product te berekenen en te vergelijken die elke reactant zal produceren. Breng de chemische vergelijking voor de chemische reactie in evenwicht. Zet de gegeven informatie om in mollen. Gebruik stoichiometrie voor elke afzonderlijke reactant om de geproduceerde massa van het product te vinden
