
- Auteur Miles Stephen [email protected].
- Public 2023-12-15 23:39.
- Laatst gewijzigd 2025-01-22 17:06.
De vier kwantumgetallen gebruikt om de te beschrijven elektronen zijn n=2, ℓ=1, m=1, 0, of -1, en s=1/2 (de elektronen parallelle spins hebben).
Bovendien, wat beschrijven de vier kwantumgetallen over een elektron?
helemaal beschrijven een elektron in een atoom, vier kwantumgetallen zijn nodig: energie (n), impulsmoment (ℓ), magnetisch moment (mℓ), en spin (ms). De eerste quantum nummer beschrijft de elektron schil, of energieniveau, van een atoom.
Evenzo, hoe vind je het kwantumaantal elektronen? Hoe het aantal elektronen te bepalen met kwantumgetallen?
- Tel de volledige orbitalen.
- Voeg de elektronen toe voor elke volledige orbitaal.
- Identificeer de subshell aangegeven door het hoekige kwantumgetal.
- Voeg de elektronen van de volledige subshells toe.
- Voeg de elektronen van volledige subschillen toe aan die van volledige orbitalen.
- Vind de legitieme waarden voor het magnetische kwantumgetal.
Ook om te weten, wat zijn de vier kwantumgetallen?
In atomen zijn er in totaal vier kwantumgetallen: het hoofdkwantumgetal (n), de orbitaal kwantumgetal van impulsmoment (l), de magnetisch kwantumgetal (mik), en het elektron spin kwantumgetal (ms).
Wat is een subschaal?
EEN subshell is een onderverdeling van elektronenschillen gescheiden door elektronenorbitalen. Subshells zijn gelabeld s, p, d en f in een elektronenconfiguratie.
Aanbevolen:
Hoe is de elektronenconfiguratie gerelateerd aan kwantumgetallen?
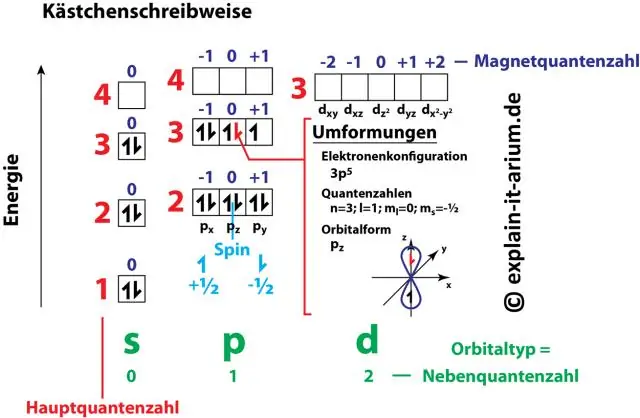
De cijfer- en letterparen in een elektronenconfiguratie vertegenwoordigen twee van de vier kwantumgetallen van het elektron. Deze kwantumgetallen vertellen ons meer informatie over de eigenschappen van elektronen en hun orbitalen. Het belangrijkste kwantumgetal (n) vertelt ons het energieniveau en de grootte van een elektron
Wat zijn de zes essentiële elementen van geografie zoals gedefinieerd door de National Council for Geographic Education?

Identificeer en pas de zes essentiële elementen van geografie toe (d.w.z. de wereld in ruimtelijke termen, plaatsen en regio's, fysieke systemen, menselijke systemen, omgeving en samenleving, en gebruik van geografie), inclusief de specifieke termen voor elk element
Hoeveel magnetische krachten zijn er gedefinieerd?

Je kunt over alle 14 Krachten van Magnetisme lezen op de ANCC-website - de lijst gaat vergezeld van een korte beschrijving van waarom elk belangrijk is. Maar in wezen belichamen de "Krachten" een professionele omgeving waarin de bijdragen van verpleegkundigen worden gewaardeerd en verpleegkundigen een stem hebben
Hoe worden ionbindingen gedefinieerd?

De definitie van ionische binding is wanneer een positief geladen ion een binding vormt met een negatief geladen ion en het ene atoom elektronen naar het andere overdraagt. Een voorbeeld van een ionische binding is de chemische verbinding natriumchloride
Wat is chemie met kwantumgetallen?

In atomen zijn er in totaal vier kwantumgetallen: het hoofdkwantumgetal (n), het kwantumgetal van het baanimpulsmoment (l), het magnetische kwantumgetal (ml) en het kwantumgetal van de elektronenspin (ms). Met andere woorden, het verwijst naar de grootte van de orbitaal en het energieniveau waarin een elektron is geplaatst
