
- Auteur Miles Stephen [email protected].
- Public 2024-01-18 08:17.
- Laatst gewijzigd 2025-01-22 17:06.
Volg deze regels om eenvoudige redoxvergelijkingen in evenwicht te brengen:
- Schrijven de oxidatie en vermindering voor de helft- reacties voor de soort die is verminderd of geoxideerd .
- Vermenigvuldig de helft- reacties door het juiste aantal zodat ze een gelijk aantal elektronen hebben.
- Voeg de twee toe vergelijkingen om de elektronen op te heffen.
Bovendien, wat is oxidatie en reductie bijvoorbeeld?
Vermindering is het proces van het verkrijgen van een of meer elektronen. in een oxidatie - vermindering , of redoxreactie, zal een atoom of verbinding elektronen stelen van een ander atoom of een andere verbinding. Een klassieker voorbeeld van een redoxreactie is roesten. Zuurstof krijgt verminderd terwijl ijzer krijgt geoxideerd.
Weet ook, wat veroorzaakt oxidatie? De belangrijkste spelers voor corrosie en oxidatie zijn zuurstof en luchtvochtigheid. Het is een chemische reactie van het metalen oppervlak met de zuurstof die oorzaken een deel van het metaal corrodeert (of in andere termen oxideert) en vormt de oxidatie of beter bekend als metaal oxyde op het oppervlak.
Hoe bepaal je hierbij oxidatie en reductie?
Huis
- Wijs oxidatiegetallen toe aan alle atomen in de vergelijking.
- Vergelijk oxidatiegetallen van de reactantzijde met de productzijde van de vergelijking.
- Het geoxideerde element is het element waarvan het oxidatiegetal toenam.
- Het gereduceerde element is het element waarvan het oxidatiegetal is afgenomen.
Wat is een voorbeeld van een redoxreactie in het dagelijks leven?
Alledaagse redoxreacties omvatten fotosynthese, ademhaling, verbranding en corrosie.
Aanbevolen:
Hoe schrijf je de formule voor een verbinding die een polyatomisch ion bevat?
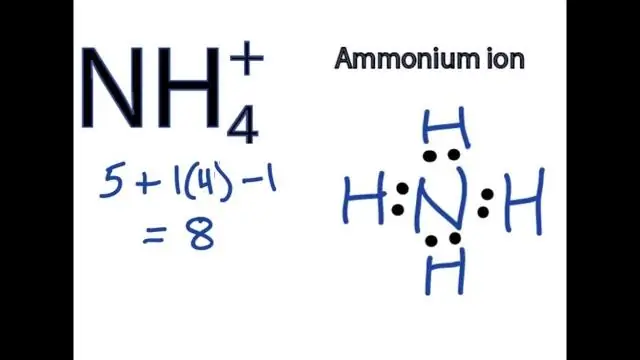
Om formules te schrijven voor verbindingen die polyatomaire ionen bevatten, schrijft u het symbool voor het metaalion gevolgd door de formule voor het polyatomaire ion en brengt u de ladingen in evenwicht. Om een verbinding te noemen die een polyatomisch ion bevat, vermeldt u eerst het kation en vervolgens het anion
Hoe schrijf je PbO?

Een beschrijving van het schrijven van de naam voor PbO, Lood (II) oxide. Eerst bepalen we met behulp van het periodiek systeem of PbO een ionische of moleculaire (covalente) verbinding is. Uit het periodiek systeem is Pb een metaal en is O een niet-metaal. Daarom is PbO een ionische verbinding omdat het bestaat uit een metaal en een niet-metaal
Hoe schrijf je een vergelijking in punthellingvorm gegeven twee punten?

Er zijn verschillende vormen waarmee we de vergelijking van een lijn kunnen schrijven: de punt-hellingvorm, de helling-snijvorm, de standaardvorm, enz. De vergelijking van een lijn gegeven twee punten (x1, y1) en (x2, y2 ) waardoor de lijn gaat, wordt gegeven door, ((y - y1)/(x - x1)) / ((y2 - y1)/(x2 - x1))
Hoe schrijf je ernst?

Bijvoeglijk naamwoord, se·ver·er, se·ver·est. wreed; onnodig extreem: zware kritiek; strenge wetten. ernstig of streng in manier of uiterlijk: een ernstig gezicht. graf; kritiek: een ernstige ziekte. moeilijk te verdragen, uit te voeren, te vervullen, enz.: een zware test van zijn krachten
Hoe schrijf je atoomnotatie?

Het atoomnummer wordt geschreven als een subscript aan de linkerkant van het elementsymbool, het massagetal wordt geschreven als een superscript aan de linkerkant van het elementsymbool en de ionische lading, indien aanwezig, verschijnt als een superscript aan de rechterkant van de element symbool. Als de lading nul is, wordt er niets geschreven in de ladingspositie
