
Inhoudsopgave:
- Auteur Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:39.
- Laatst gewijzigd 2025-01-22 17:06.
Stappen
- Vind het atoomnummer van je atoom.
- Bepaal de lading van het atoom.
- Onthoud de basislijst van orbitalen.
- Begrijp de notatie van de elektronenconfiguratie.
- Onthoud de volgorde van de orbitalen.
- Vul de orbitalen in volgens het aantal elektronen in je atoom.
- Gebruik het periodiek systeem als een visuele snelkoppeling.
Evenzo, wat zijn de stappen om de elektronenconfiguratie te schrijven?
Stappen
- Vind het atoomnummer van je atoom.
- Bepaal de lading van het atoom.
- Onthoud de basislijst van orbitalen.
- Begrijp de notatie van de elektronenconfiguratie.
- Onthoud de volgorde van de orbitalen.
- Vul de orbitalen in volgens het aantal elektronen in je atoom.
- Gebruik het periodiek systeem als een visuele snelkoppeling.
Ten tweede, wat is Subshell? EEN subshell is een onderverdeling van elektronenschillen gescheiden door elektronenorbitalen. Subshells zijn gelabeld s, p, d en f in een elektronenconfiguratie.
Evenzo wordt gevraagd, wat is de Hund-regel?
De regel van Hund . De regel van Hund : elke orbitaal in een subschil is afzonderlijk bezet met één elektron voordat een orbitaal dubbel bezet is, en alle elektronen in enkelvoudig bezette orbitalen hebben dezelfde spin.
Hoeveel elektronen zitten er in elke schil?
Elke schil kan slechts een vast aantal elektronen bevatten: de eerste schil kan maximaal bevatten twee elektronen , de tweede schil kan maximaal acht (2 + 6) elektronen bevatten, de derde schil kan maximaal bevatten 18 (2 + 6 + 10) enzovoort. De algemene formule is dat de n-de schaal in principe maximaal 2(n. kan bevatten)2) elektronen.
Aanbevolen:
Hoe schrijf je de elektronenconfiguratie voor MN?

Mangaan daarentegen heeft een elektronenconfiguratie van 1s22s22p63s23p64s23d5 en een edelgasconfiguratie van [Ar]4s23d5, wat resulteert in één ongepaard elektron in elke 3D-suborbitaal
Hoe vind je de elektronenconfiguratie voor zuurstof?

Bij het schrijven van de elektronenconfiguratie voor zuurstof gaan de eerste twee elektronen in de 1s-orbitaal. Aangezien 1s slechts twee elektronen kan bevatten, gaan de volgende 2 elektronen voor O in de 2s-orbitaal. De overige vier elektronen gaan in de 2p-orbitaal. Daarom is de O-elektronenconfiguratie 1s22s22p4
Hoe teken je een vergelijking stap voor stap?
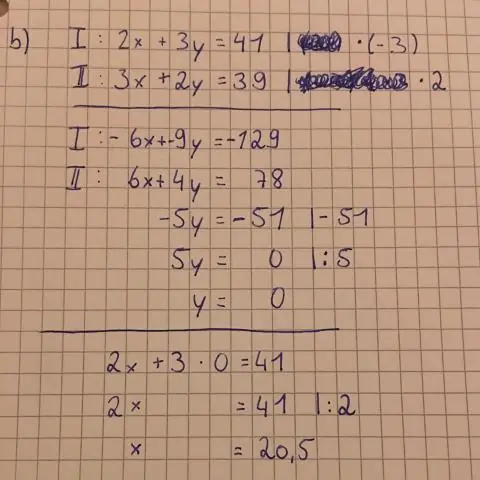
Hier zijn enkele te volgen stappen: Vul x = 0 in de vergelijking in en los op voor y. Zet het punt (0,y) op de y-as. Vul y = 0 in de vergelijking in en los op voor x. Teken het punt (x,0) op de x-as. Trek een rechte lijn tussen de twee punten
Hoe vind je de elektronenconfiguratie voor zilver?

De elektronenconfiguratie van de grondtoestand van gasvormig neutraal zilver in de grondtoestand is [Kr]. 4d10. 5s1 en de term symbool is 2S1/2
Hoe maak je stap voor stap een helling?

Er zijn drie stappen bij het berekenen van de helling van een rechte lijn als u de vergelijking niet krijgt. Stap één: identificeer twee punten op de lijn. Stap twee: Selecteer een om (x1, y1) te zijn en de andere om (x2, y2) te zijn. Stap drie: gebruik de hellingsvergelijking om de helling te berekenen
