
- Auteur Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:39.
- Laatst gewijzigd 2025-01-22 17:06.
1 anorganisch zout hydrateert als PCM's. Zout hydraten vormen een belangrijke groep PCM's. een anorganische zout hydraat ( gehydrateerd zout of hydrateren ) is een ionische verbinding waarin een aantal watermoleculen worden aangetrokken door de ionen en daarom zijn ingesloten in het kristalrooster. De algemene formule van een gehydrateerd zout is MxNja
Hierin, wat zijn gehydrateerde zouten geven voorbeelden?
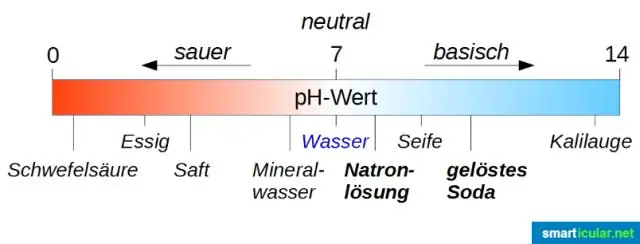
Andere voorbeelden van hydraten zijn Glauber's zout ( sodium sulfaat decahydraat, Na2DUS4∙10H2O); wasmiddel ( natrium carbonaatdecahydraat, Na2CO3∙10H2O); borax ( natrium tetraboraatdecahydraat, Na2B4O7∙10H2O); de sulfaten bekend als vitriolen (bijv. Epsom-zout, MgSO4∙7H2O); en de dubbelzouten die gezamenlijk bekend staan als aluin (M+2
Weet ook, hoe vind je het percentage water in een gehydrateerd zout? De theoretische (werkelijke) procent hydratatie ( procent water ) kan zijn berekend van de formule van de hydrateren door de massa van te delen water in een mol van de hydrateren door de molaire massa van de hydrateren en vermenigvuldigen met 100.
Wat dit betreft, wat is een gehydrateerd zout in de chemie?
EEN gehydrateerd zout is een kristallijne zout molecuul dat losjes is bevestigd aan een bepaald aantal watermoleculen. Zout ontstaat wanneer het anion van een zuur en het kation van een base worden gecombineerd om een zuur-base-molecuul te produceren. In een gehydrateerd zout , worden de watermoleculen opgenomen in de kristallijne structuur van de zout.
Wat is het verschil tussen gehydrateerd zout en watervrij zout?
Verschil tussen gehydrateerd zout en watervrij zout . De sleutel verschil tussen gehydrateerd zout en watervrij zout is dat de gehydrateerd zout moleculen zijn gehecht aan watermoleculen terwijl de watervrij zout moleculen zijn niet gehecht aan watermoleculen. We noemen deze watermoleculen "kristallisatiewater".
Aanbevolen:
Wat is de naam van het zout dat wordt gevormd door de neutralisatie van zoutzuur en natriumhydroxide?
Toelichting: De reactie tussen natriumhydroxide (NaOH) en zoutzuur (HCl) is een neutralisatiereactie die resulteert in de vorming van een zout, natriumchloride (NaCl) en water (H2O). Het is een exotherme reactie
Wat is het zout van een afbeelding in een vlakke spiegel?

ZOUT. Is het beeld voor of achter de spiegel. Is het beeld dichterbij of verder weg van de spiegel dan het object?
Wat voor soort mengsel is suiker en zout?

Het mengen van twee vaste stoffen, zonder ze samen te smelten, resulteert meestal in een heterogeen mengsel. Voorbeelden zijn zand en suiker, zout en grind, een mand met producten en een speelgoeddoos gevuld met speelgoed. Mengsels in twee of meer fasen zijn heterogene mengsels
Wat is de juiste formule van het zout dat wordt gevormd bij de neutralisatiereactie van zoutzuur met bariumhydroxide?

Vraag: Wat is de juiste formule van het zout dat wordt gevormd bij de neutralisatiereactie van zoutzuur met bariumhydroxide? BaCl BaCl2 BaClH BaH2 BaO
Wat doet het zout met het celmengsel?

Het verbrijzelen van de kiwi/aardbeien breekt de celwanden fysiek uit elkaar. Waarom gebruiken we shampoo? Nadat de celwanden zijn verstoord tijdens het mechanisch pureren van het fruit, verstoort het wasmiddel in de shampoo de cel- en kernmembranen van elke cel om het DNA vrij te maken
