
- Auteur Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:39.
- Laatst gewijzigd 2025-06-01 05:05.
Covalente binding is het type binding dat de atomen binnen een polyatomisch ion bij elkaar houdt. Er zijn twee elektronen nodig om a. te maken covalente binding , één van elk bindend atoom. Lewis-puntstructuren zijn een manier om weer te geven hoe atomen zich vormen covalente bindingen.
Evenzo, hoe combineer je polyatomaire ionen?
Een andere manier om te vormen Polyatomische ionen is van combineren ze met een of meer waterstof ionen , H+. We zouden bijvoorbeeld kunnen combineren H+ met carbonaat, CO32- waterstofcarbonaat vormen, HCO3-. Merk op dat de totale lading 1- is omdat de 1+ op H+ combineren met de 2- op CO32-.
Men kan zich ook afvragen, zijn verbindingen met polyatomaire ionen ionisch of covalent? Polyatomische ionen zijn ionen . Echter, de atomen in Polyatomische ionen worden bij elkaar gehouden door covalent obligaties. verbindingen bevattende Polyatomische ionen zijn Ionische bestanddelen . De basisregel is: Ionische bestanddelen plaatsvinden tussen een positieve ionisch metaal en een negatief ionisch niet-metaal.
Daarnaast, welke combinatie van elementen zal een ionische binding vormen?
Een ionbinding is een soort chemische stof verbintenis gevormd door een elektrostatische aantrekking tussen twee tegengesteld geladen ionen . Ionische bindingen worden gevormd tussen een kation, dat meestal een metaal is, en een anion, dat meestal een niet-metaal is. een covalente verbintenis houdt in dat een paar elektronen wordt gedeeld tussen atomen.
Welke twee elementen zijn het meest waarschijnlijk met elkaar verbonden?
Zuurstof (O) en fluor (F) zijn twee goede voorbeelden. Elk van die elementen is op zoek naar een paar elektronen om een gevulde schil te maken. Ze hebben elk een gevulde schil met twee elektronen, maar hun tweede schil wil er acht hebben.
Aanbevolen:
Wat is de aantrekkingskracht die atomen of ionen bij elkaar houdt?

Chemische bindingen
Wat zijn de gebruikelijke polyatomaire ionen?

Gemeenschappelijke polyatomaire ionen Zn2+ zink. Cd2+ Cadmium. 1+ lading. NH4. Ammonium. Hg2. Mercurius (I) Ag+ Zilver. 1- lading. C2H3O2. Acetaat. CN-Cyanide. ClO-hypochloriet. ClO2. Chloriet. ClO3. Chloraat. ClO4. Perchloraat. HCO3. Waterstof (bi)carbonaat. H2PO4
Hoe bind je polyatomaire ionen?
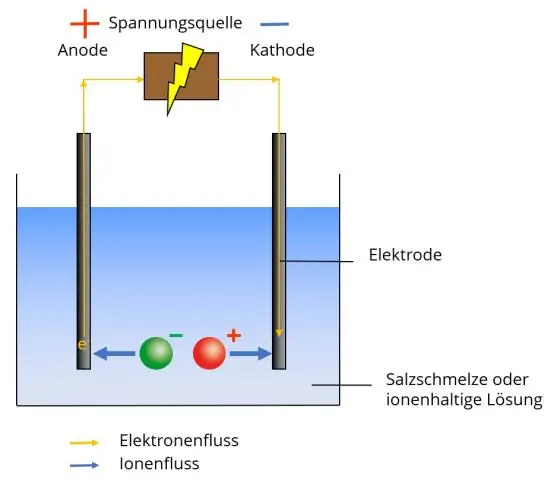
Een polyatomair ion heeft twee of meer covalent gebonden atomen die als een enkel ion werken. Het polyatomaire ion vormt ionische bindingen met andere ionen en fungeert extern als een eenheid, net als monoatomaire ionen
Gebruik je voorvoegsels bij het benoemen van polyatomaire ionen?

Polyatomaire ionen hebben speciale namen. Velen van hen bevatten zuurstof en worden oxyanionen genoemd. Wanneer verschillende oxyanionen zijn gemaakt van hetzelfde element, maar een verschillend aantal zuurstofatomen hebben, dan worden voor- en achtervoegsels gebruikt om ze van elkaar te onderscheiden
Hoe noem je zuren met polyatomaire ionen?

Zuren benoemen Elk polyatomair ion met het achtervoegsel "-ate" gebruikt het achtervoegsel "-ic" als een zuur. Als je een polyatomisch ion hebt met één zuurstof meer dan het "-ate" -ion, dan heeft je zuur het voorvoegsel "per-" en het achtervoegsel "-ic". Het chloraation is bijvoorbeeld ClO3–
