
- Auteur Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:39.
- Laatst gewijzigd 2025-01-22 17:06.
De vrij eenvoudige vergelijking voor het bepalen van kookpunt van een oplossing: delta T = mKb. Delta T verwijst naar de kokend - punt hoogte , of hoeveel groter de oplossing is kookpunt is dan die van het zuivere oplosmiddel. De eenheden zijn graden Celsius. Kb is de molal kokend - punt hoogte constante.
Bovendien, wat veroorzaakt kookpuntverhoging?
Kookpunt verhoging is de temperatuur - verandering (verhoging) van de kookpunt van een oplosmiddel veroorzaakt door een opgeloste stof toe te voegen. Als de dampdruk wordt verlaagd, neemt het relatieve aantal deeltjes dat een gas wordt, af. Deze toename resulteert in de vloeistof kokend op een hoger niveau temperatuur -.
Men kan zich ook afvragen, welke heeft het hoogste kookpunt? Onder de gegeven edelgassen Xenon heeft het hoogste kookpunt.
Vervolgens is de vraag, wat is de constante kookpuntverhoging?
de evenredigheid constante , Kb, heet de molal kokend - punt hoogte constante . Het is een constante dat is gelijk aan de verandering in de kookpunt voor een 1-molale oplossing van een niet-vluchtige moleculaire opgeloste stof. Voor water , de waarde van Kb is 0,512oC/m.
Welke stof heeft het hoogste kookpunt?
Het scheikundige element met het laagste kookpunt is helium en het element met het hoogste kookpunt is Wolfraam.
Aanbevolen:
Hoe bereken je de standaarddeviatie van PMP?

De formule die in de PMBOK voor standaarddeviatie wordt gebruikt, is eenvoudig. Het is gewoon (P-O)/6. Dat is de pessimistische schatting van de activiteit minus de optimistische schatting van de activiteit gedeeld door zes. Het probleem is dat deze vorm op geen enkele manier een maat voor standaarddeviatie oplevert
Hoe bereken je de omtrek van de aarde op haar breedtegraad?

De omtrek van een cirkel is gelijk aan 2πr waarbij r de straal is. Op aarde is de omtrek van de bol op een bepaalde breedtegraad 2πr(cos θ) waarbij θ is de breedtegraad en r is de straal van de aarde op de evenaar
Hoe bereken je frequentie uit frequentie en procent?
Om dit te doen, deelt u de frequentie door het totaal aantal resultaten en vermenigvuldigt u met 100. In dit geval is de frequentie van de eerste rij 1 en het totale aantal resultaten is 10. Het percentage zou dan 10,0 zijn. De laatste kolom is Cumulatief percentage
Hoe bereken je potentiële daling in een circuit?
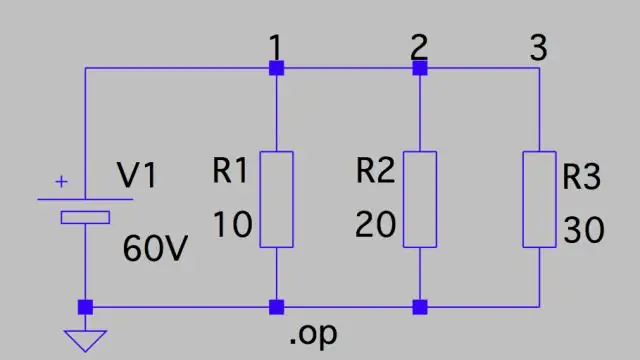
Spanningsval: parallel circuit Dit betekent dat de spanningsval over elk circuit slechts de totale spanning van het circuit is, gedeeld door het aantal weerstanden in het circuit, of 24 V/3 = 8 V
Hoe bereken je hoe ver een object zal reizen?

De afgelegde horizontale afstand kan worden uitgedrukt als x = Vx * t, waarbij t de tijd is. Verticale afstand tot de grond wordt beschreven door de formule y = h + Vy * t – g * t² / 2, waarbij g de zwaartekrachtversnelling is
