
- Auteur Miles Stephen [email protected].
- Public 2023-12-15 23:39.
- Laatst gewijzigd 2025-01-22 17:06.
Het Aufbau-principe schetst de regels die worden gebruikt om te bepalen hoe elektronen zich organiseren in schillen en subschillen rond de atoomkern
- Elektronen gaan de subshell in met de laagst mogelijke energie.
- Een orbitaal kan maximaal 2 elektronen bevatten die voldoen aan de Pauli uitsluitingsprincipe .
Ook om te weten is, wat is het voorbeeld van het Aufbau-principe?
De Aufbau-principe dicteert de manier waarop elektronen worden gevuld in de atomaire orbitalen van een atoom in zijn grondtoestand. Het stelt dat elektronen worden gevuld in atomaire orbitalen in toenemende volgorde van orbitaal energieniveau. Voor voorbeeld , koolstof heeft 6 elektronen en de elektronische configuratie is 1s22s22p2.
Waarom is naast bovenstaande het Aufbau-principe belangrijk? Aufbau-principe . We kunnen de orbitalen voor de elektronen in atomen met meerdere elektronen bepalen door de elektronen in subschillen van steeds toenemende energie te plaatsen. Het is belangrijk om in gedachten te houden dat de Aufbau-principe vertegenwoordigt en benadert de trend die in de meeste gevallen geldt.
Wat is op deze manier het Aufbau-principe en de regel van Hund?
Aufbau-principe : orbitalen met lagere energie vullen zich voor orbitalen met hogere energie. De regel van Hund : er gaat één elektron in elk totdat ze allemaal halfvol zijn voordat ze worden gekoppeld. Uitsluitingsprincipe van Pauli : geen twee elektronen kunnen worden geïdentificeerd door dezelfde reeks kwantumgetallen (d.w.z. moeten verschillende spins hebben).
Wie heeft het Aufbau-principe voorgesteld?
Niels Bohr
Aanbevolen:
Wat is het verschil tussen algemene chemie en organische chemie?
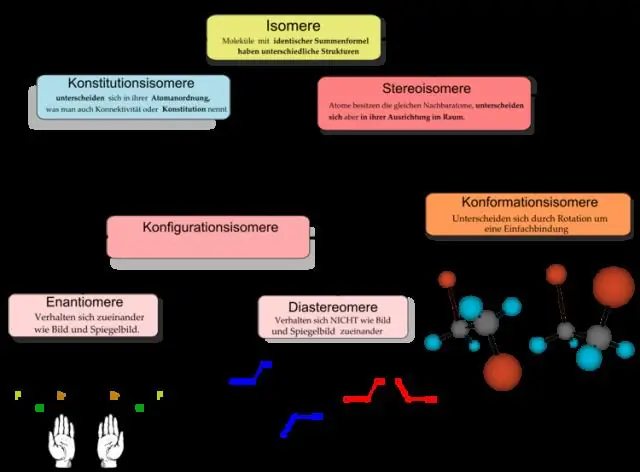
Organische chemie wordt beschouwd als een subdiscipline van de chemie. Terwijl de algemene overkoepelende term 'chemie' betrekking heeft op de samenstelling en transformaties van alle materie in het algemeen, beperkt de organische chemie zich tot de studie van alleen organische verbindingen
Wanneer gebruik je de activiteitenreeks hoe gebruik je hem?

Het wordt gebruikt om de producten van enkelvoudige verplaatsingsreacties te bepalen, waarbij metaal A een ander metaal B in een oplossing zal vervangen als A hoger in de reeks is. Activiteitenreeksen van enkele van de meest voorkomende metalen, gerangschikt in aflopende volgorde van reactiviteit
Welke golfachtige eigenschap van licht zorgt ervoor dat het van richting verandert wanneer het van het ene medium naar het andere gaat?

breking Wat dit betreft, waarom veranderen golven van richting wanneer ze van het ene materiaal naar het andere reizen? De reden dat de dichtheid het is verander richting is alsof de trillingen verschillende snelheden hebben en door de media gaan.
Hoe gebruik je gebogen pijlen in de organische chemie?
Het doel van de gebogen pijl is om de beweging van elektronen van de ene plaats naar de andere te laten zien. Elektronen gaan van de staart naar de kop. De meeste pijlen die je ziet hebben een dubbele weerhaak aan de kop, die de beweging van een elektronenpaar voorstelt
Wat is uw groepsdefinitie van het woord deeltje zoals het in de chemie wordt gebruikt?

Wat is de definitie van uw groep van het woord 'deeltje' zoals het in de chemie wordt gebruikt? Een deeltje is een enkel atoom of een groep atomen die aan elkaar zijn gebonden en als één eenheid functioneren. · Antwoorden kunnen verschillen
