- Auteur Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:39.
- Laatst gewijzigd 2025-01-22 17:06.
Zodat we berekenen het door het nemen van de gewogen massa - van elk van de isotopen en deze bij elkaar op te tellen. Dus voor het eerst massa -, vermenigvuldigen we 0,50% van 84 (amu - atoom massa eenheden) = 0,042 amu, en voeg het toe aan 9,9% van 86 amu = 8,51 amu, enzovoort.
Vervolgens kan men zich ook afvragen: hoe bereken je de gemiddelde atoommassa?
Gemiddelde atoommassa berekenen De gemiddelde atoommassa van een element is de som van de massa's van zijn isotopen, elk vermenigvuldigd met zijn natuurlijke overvloed (de decimaal geassocieerd met percentage van atomen van dat element die van een bepaalde isotoop zijn). Gemiddelde atoommassa = f1m1 + f2m2 +…
Weet ook, welke drie soorten informatie zijn nodig om een gemiddelde atomaire massa te berekenen? Het aantal isotopen dat voor het element bestaat. De atoom Nummer Voor Het Element. Het percentage overvloed van elke isotoop.
Men kan zich ook afvragen, welke waarde ligt het dichtst bij de atomaire massa van strontium?
Strontium . In haar rapport uit 1961 adviseerde de Commissie AR(Sr) = 87,62 gebaseerd op de massa --spectrometrische bepaling van Nier. Dit waarde werd herzien tot AR(Sr) = 87,62(1) in 1969 en is sindsdien onveranderd gebleven.
Wat heeft een massa van 1 amu?
Een atomaire massa-eenheid (gesymboliseerd AMU of amu) wordt gedefinieerd als precies 1/12 van de massa van een atoom van koolstof-12. Het koolstof-12 (C-12) atoom heeft zes protonen en zes neutronen in zijn kern. In onnauwkeurige termen is één AMU het gemiddelde van de proton rustmassa en de neutron rust massa.
Aanbevolen:
Wat is de gemiddelde atoommassa van een atoom?

De gemiddelde atomaire massa van een element is de som van de massa's van zijn isotopen, elk vermenigvuldigd met zijn natuurlijke overvloed (het decimaalteken geassocieerd met het percentage atomen van dat element dat van een bepaalde isotoop is). Gemiddelde atoommassa = f1M1 + f2M2 +
Hoe wordt de gemiddelde atoommassa in het periodiek systeem bepaald?
De gemiddelde atomaire massa van een element wordt berekend door de massa's van de isotopen van het element op te tellen, elk vermenigvuldigd met de natuurlijke overvloed op aarde. Gebruik bij het uitvoeren van massaberekeningen met elementen of verbindingen altijd de gemiddelde atomaire massa, die te vinden is in het periodiek systeem
Hoe bereken je de atoommassa van boor?
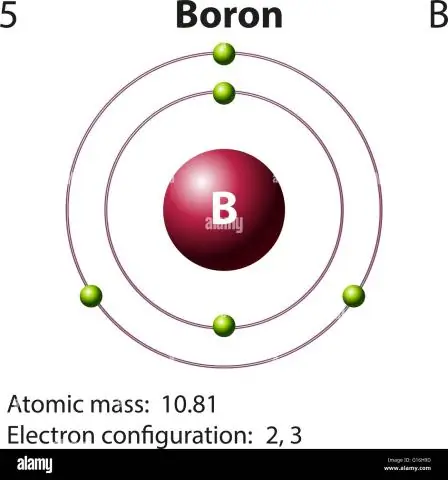
Voor boor ziet deze vergelijking er als volgt uit: 5 protonen + 5 neutronen = 10 atomaire massa-eenheden (AMU) of, voor de meer algemeen voorkomende boorisotoop (ongeveer 5 protonen + 6 neutronen = 11 AMU
Wat is de gemiddelde gemiddelde temperatuur op aarde?

De nationale gemiddelde temperatuur was 2,91 ° C (5,24 ° F) boven het gemiddelde van 1961-1990, waardoor het vorige record in 2013 werd verbroken met 0,99 ° C (1,78 ° F)
Hoe bereken je het gemiddelde in PHP?
Wanneer u het gemiddelde wilt krijgen, deelt u de som door de telling (let natuurlijk op het geval van telling == 0). Telkens wanneer u een nieuw getal wilt opnemen, voegt u het nieuwe getal toe aan de som en verhoogt u de telling met 1
