Inhoudsopgave:
- Auteur Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:39.
- Laatst gewijzigd 2025-01-22 17:06.
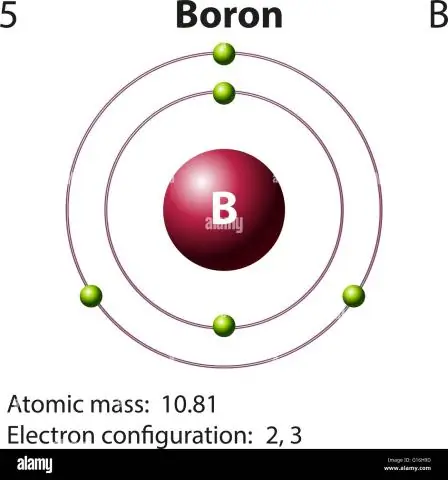
Voor boor ziet deze vergelijking er als volgt uit:
- 5 protonen + 5 neutronen = 10 atoom massa eenheden (AMU) of, voor de meest voorkomende borium isotoop (ca.
- 5 protonen + 6 neutronen = 11 AMU.
Dit in overweging nemend, wat is de atomaire massa van boor?
10.811 u
En hoe bereken je de atomaire massa van neon? 20.1797 u
Mensen vragen ook: hoe bereken je de atoommassa?
Tot bereken de atoommassa van een single atoom van een element, tel de. bij elkaar op massa - van protonen en neutronen. Voorbeeld: Zoek de atoom massa van een isotoop van koolstof met 7 neutronen. Je kunt aan het periodiek systeem zien dat koolstof een atomair getal van 6, wat het aantal protonen is.
Wat heeft een massa van 1 amu?
Een atomaire massa-eenheid (gesymboliseerd AMU of amu) wordt gedefinieerd als precies 1/12 van de massa van een atoom van koolstof-12. Het koolstof-12 (C-12) atoom heeft zes protonen en zes neutronen in zijn kern. In onnauwkeurige termen is één AMU het gemiddelde van de proton rustmassa en de neutron rust massa.
Aanbevolen:
Wat is de gemiddelde atoommassa van een atoom?

De gemiddelde atomaire massa van een element is de som van de massa's van zijn isotopen, elk vermenigvuldigd met zijn natuurlijke overvloed (het decimaalteken geassocieerd met het percentage atomen van dat element dat van een bepaalde isotoop is). Gemiddelde atoommassa = f1M1 + f2M2 +
Hoe bereken je de gemiddelde atoommassa van strontium?

We berekenen het dus door de gewogen massa van elk van de isotopen te nemen en ze bij elkaar op te tellen. Dus voor de eerste massa vermenigvuldigen we 0,50% van 84 (amu - atomaire massa-eenheden) = 0,042 amu, en voegen het toe aan 9,9% van 86 amu = 8,51 amu, enzovoort
Hoe wordt de gemiddelde atoommassa in het periodiek systeem bepaald?

De gemiddelde atomaire massa van een element wordt berekend door de massa's van de isotopen van het element op te tellen, elk vermenigvuldigd met de natuurlijke overvloed op aarde. Gebruik bij het uitvoeren van massaberekeningen met elementen of verbindingen altijd de gemiddelde atomaire massa, die te vinden is in het periodiek systeem
Hebben alle atomen van magnesium dezelfde atoommassa?

A: Magnesium heeft in zijn elementaire vorm 12 protonen en 12 elektronen. De neutronen zijn een andere zaak. De gemiddelde atoommassa van Magesium is 24.305 atomaire massa-eenheden, maar geen enkel magnesiumatoom heeft precies deze massa
Wat is de som van de atoommassa's van alle atomen in een formule voor een verbinding?

De formulemassa van een stof is de som van de gemiddelde atoommassa's van elk atoom weergegeven in de chemische formule en wordt uitgedrukt in atomaire massa-eenheden. De formulemassa van een covalente verbinding wordt ook wel de molecuulmassa genoemd
