
- Auteur Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:39.
- Laatst gewijzigd 2025-01-22 17:06.
Milieuwetenschap voor Dummies
Wanneer twee atomen samenkomen in a covalente binding vormen ze een molecuul dat elektronen deelt. Anders dan in de ionic verbintenis , geen van de atomen in a covalente binding verliest of krijgt een elektron; in plaats daarvan gebruiken beide atomen een paar gedeelde elektronen.
Trouwens, wat zijn eenvoudige termen voor covalente bindingen?
Covalente bindingen zijn chemisch obligaties tussen twee niet-metaalatomen. Een voorbeeld is water, waarbij waterstof (H) en zuurstof (O) verbintenis samen te maken (H2O). Een volledige buitenste schil heeft meestal acht elektronen, of twee in het geval van waterstof of helium. Covalente bindingen worden gevormd door atomen die valentie-elektronen delen.
Vervolgens is de vraag, wat is een ionische binding voor dummies? Milieuwetenschap voor Dummies Om moleculen te vormen, moeten atomen elektronen uit hun buitenste elektronenschil uitwisselen of delen om atoom te creëren obligaties . Een ionbinding treedt op wanneer een atoom een elektron aan een ander atoom geeft. Atomen die op deze manier aan elkaar zijn gekoppeld, worden ionisch verbindingen.
Simpel gezegd, hoe beschrijf je een covalente binding?
EEN covalente binding , ook wel een moleculaire verbintenis , is een chemische stof verbintenis dat omvat het delen van elektronenparen tussen atomen. Deze elektronenparen staan bekend als gedeelde paren of binding paren, en de stabiele balans van aantrekkende en afstotende krachten tussen atomen, wanneer ze elektronen delen, staat bekend als covalente binding.
Wat is een covalente binding en geef voorbeelden?
Voorbeelden van verbindingen die alleen covalente bindingen zijn methaan (CH4), koolmonoxide (CO) en jodiummonobromide (IBr). Covalente binding tussen waterstofatomen: aangezien elk waterstofatoom één elektron heeft, kunnen ze hun buitenste schillen vullen door een elektronenpaar te delen via een covalente binding.
Aanbevolen:
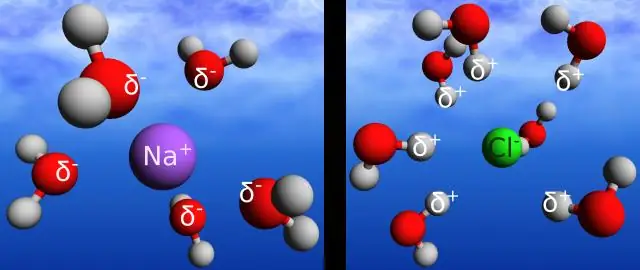
Bevat NaCl een apolaire covalente binding?

Ja, NaCl is een ionische binding waardoor het polair is. Het verschil in elektronegativiteiten is wat een binding polair of niet-polair maakt. Als twee atomen in een binding dezelfde elektronegativiteit hebben (bijvoorbeeld die uit twee dezelfde atomen bestaat), is de binding niet-polair omdat beide atomen een gelijke aantrekkingskracht hebben op elektronen
Hoe verschilt een covalente binding van een quizlet met ionische bindingen?

Het verschil tussen een ionische en een covalente binding is dat een covalente binding wordt gevormd wanneer twee atomen elektronen delen. Ionische bindingen zijn krachten die elektrostatische aantrekkingskrachten tussen tegengesteld geladen ionen bij elkaar houden. Ionische bindingen hebben een elektronegativiteitsverschil groter dan of gelijk aan 2
Is een waterstofbinding hetzelfde als een covalente binding?
Waterstofbinding is de naam die wordt gegeven aan de elektrostatische interactie tussen de positieve lading op een waterstofatoom en de negatieve lading op het zuurstofatoom van een naburig molecuul. De covalente binding is de elektrostatische interactie tussen twee atomen in hetzelfde molecuul
Wat zijn de regels voor covalente binding?

De Octet-regel vereist dat alle atomen in een molecuul 8 valentie-elektronen hebben - hetzij door elektronen te delen, te verliezen of te verkrijgen - om stabiel te worden. Voor covalente bindingen hebben atomen de neiging hun elektronen met elkaar te delen om aan de Octet-regel te voldoen. Het wil zijn als Argon die een volledige buitenste valentieschaal heeft
Heeft Co een polaire covalente binding?

Koolmonoxide is een hetero-nucleair diatomisch molecuul. Het is een polair covalent molecuul omdat het elektronegativiteitsverschil van zuurstof en koolstof groter is dan 0,4 en vormt daarom een polaire covalente binding
