
- Auteur Miles Stephen [email protected].
- Public 2023-12-15 23:39.
- Laatst gewijzigd 2025-01-22 17:06.
coëfficiënten zijn belangrijk om de wet van behoud van massa te bewijzen. De coëfficiënten in een evenwichtige chemisch vergelijking geef het relatieve aantal mol reactanten en producten aan. Uit deze informatie kunnen de componenten van reactanten en producten worden berekend. U kunt het aantal mol van het product bepalen.
Weet ook, wat is de betekenis van de coëfficiënten in een uitgebalanceerde chemische vergelijking?
In een evenwichtige chemische vergelijking , het totale aantal atomen van elk aanwezig element is hetzelfde aan beide zijden van de vergelijking . Stoichiometrisch coëfficiënten zijn de coëfficiënten verplicht om evenwicht een reactievergelijking . Dit zijn belangrijk omdat ze betrekking hebben op de hoeveelheden gebruikte reactanten en gevormde producten.
Bovendien, waarom is een gebalanceerde vergelijking belangrijk in stoichiometrie? De coëfficiënten van a evenwichtig chemisch vergelijking vertel ons het relatieve aantal mol reactanten en producten. Alle stoichiometrisch berekeningen beginnen met a evenwichtige vergelijking . Evenwichtige vergelijkingen zijn nodig omdat bij elke reactie massa behouden blijft. Dit is de reactant die volledig in de reactie wordt gebruikt.
Wat stellen hierin de coëfficiënten in een gebalanceerde vergelijking voor?
Eerst de coëfficiënten geef het aantal moleculen (of atomen) dat bij de reactie betrokken is. In de voorbeeldreactie reageren twee waterstofmoleculen met één zuurstofmolecuul en produceren twee moleculen water. Ten tweede: de coëfficiënten geef het aantal mol van elke stof die bij de reactie betrokken is.
Wat wordt weergegeven door de getallencoëfficiënten die in een uitgebalanceerde vergelijking voor de formules worden geplaatst?
Er zijn subscripts, die deel uitmaken van de chemische stof formules van de reactanten en producten en er zijn coëfficiënten die voor de formules worden geplaatst om aan te geven hoeveel moleculen van die stof worden gebruikt of geproduceerd. Figuur 7.4.1: Balanceren vergelijkingen.
Aanbevolen:
Welke coëfficiënten kun je gebruiken in een gebalanceerde vergelijking?

Ten eerste: de coëfficiënten geven het aantal moleculen (of atomen) aan dat bij de reactie betrokken is. In de voorbeeldreactie reageren twee waterstofmoleculen met één zuurstofmolecuul en produceren twee moleculen water. Ten tweede: de coëfficiënten geven het aantal mol van elke stof die bij de reactie is betrokken
Hoe vind je de vergelijking van een lijn gegeven een punt en een parallelle lijn?
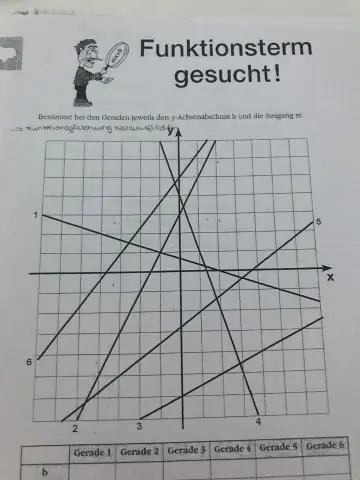
De vergelijking van de lijn in de vorm van het helling-snijpunt is y=2x+5. De helling van de parallellijn is hetzelfde: m=2. De vergelijking van de parallelle lijn is dus y=2x+a. Om a te vinden, gebruiken we het feit dat de lijn door het gegeven punt moet gaan:5=(2)⋅(&min;3)+a
Wat vertellen de coëfficiënten in een uitgebalanceerde chemische vergelijking je over de reactanten en producten?

De coëfficiënten van een uitgebalanceerde chemische vergelijking vertellen ons het relatieve aantal mol reactanten en producten. Bij het oplossen van stoichiometrische problemen worden conversiefactoren gebruikt die het aantal molen reactanten relateren aan het aantal molen producten. Bij massaberekeningen is de molaire massa nodig om massa om te zetten in mol
Zou het zinvol zijn om de vergelijking te vinden van een lijn evenwijdig aan een gegeven lijn en door een punt op de gegeven lijn?

De vergelijking van een lijn die evenwijdig aan of loodrecht staat op een gegeven lijn? Mogelijk antwoord: De hellingen van evenwijdige lijnen zijn gelijk. Vervang de bekende helling en de coördinaten van een punt op de andere lijn in de punt-hellingvorm om de vergelijking van de parallelle lijn te vinden
Wat is de vergelijking van een cirkel met een straal van 5?

De standaardvorm van een cirkel wordt hieronder gegeven: (x – h)2 + (y – k)2 = r2, waarbij het middelpunt zich op (h, k) bevindt en r de lengte van de straal is. In dit geval is h -3, k is 6 en r is 5
