
- Auteur Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:39.
- Laatst gewijzigd 2025-01-22 17:06.
De moleculaire van een reactie is het aantal moleculen dat reageert in een elementaire stap . Een unimoleculaire reactie is een reactie waarbij slechts één reagerend molecuul deelneemt aan de reactie. Twee reactantmoleculen botsen met elkaar in een bimoleculaire reactie.
Als we dit in overweging nemen, wat is dan de moleculaire aard van elke reactie?
De moleculaire voor een reactie is gedefinieerd voor elk individuele stap in het mechanisme van de reactie . Het is gelijk aan het aantal deelnemende moleculen (of reageren ) in elk elementaire stap in het mechanisme van de reactie.
Ten tweede, wat zijn de Moleculariteit en de tariefwet voor elke stap? De moleculaire van de elementaire stap , en de betrokken reactanten, zullen bepalen wat de tarief wet zal voor dat specifieke zijn stap in het mechanisme. Moleculariteit van elementair stappen en corresponderend tarief wetten : De moleculaire van een basisschool stap in een reactiemechanisme bepaalt de vorm van zijn tarief wet.
Bovendien, hoe bepaal je Moleculariteit?
In het algemeen, moleculaire van eenvoudige reacties is gelijk aan de som van het aantal moleculen van reactanten die betrokken zijn bij de gebalanceerde stoichiometrische vergelijking. De moleculaire van een reactie is het aantal reactantmoleculen dat deelneemt aan een enkele stap van de reactie.
Wat is een unimoleculaire stap?
Unimoleculaire stappen zijn stappen waarbij slechts één reactant betrokken is, bimoleculaire stappen waarbij 2 reactanten betrokken zijn. Als de stappen zijn elementair stappen in een mechanisme, de moleculaire is ook de reactievolgorde voor de snelheid. Dat is een unimoleculaire elementair stap heeft een eerste orde tarief. 2.
Aanbevolen:
Wat is de eerste stap bij het construeren van een loodlijn van een punt op een lijn?
Verbind het gegeven punt met het punt waar de bogen elkaar kruisen. Gebruik een liniaal om ervoor te zorgen dat de lijn recht is. De lijn die je tekent staat loodrecht op de eerste lijn, door het gegeven punt op de lijn
Hoe doe je de elektronenconfiguratie stap voor stap?

Stappen Zoek het atoomnummer van uw atoom. Bepaal de lading van het atoom. Onthoud de basislijst van orbitalen. Begrijp de notatie van de elektronenconfiguratie. Onthoud de volgorde van de orbitalen. Vul de orbitalen in volgens het aantal elektronen in je atoom. Gebruik het periodiek systeem als een visuele snelkoppeling
Hoe teken je een vergelijking stap voor stap?
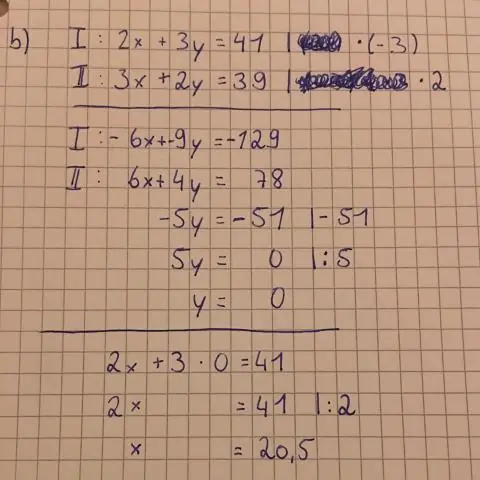
Hier zijn enkele te volgen stappen: Vul x = 0 in de vergelijking in en los op voor y. Zet het punt (0,y) op de y-as. Vul y = 0 in de vergelijking in en los op voor x. Teken het punt (x,0) op de x-as. Trek een rechte lijn tussen de twee punten
Hoe maak je stap voor stap een helling?

Er zijn drie stappen bij het berekenen van de helling van een rechte lijn als u de vergelijking niet krijgt. Stap één: identificeer twee punten op de lijn. Stap twee: Selecteer een om (x1, y1) te zijn en de andere om (x2, y2) te zijn. Stap drie: gebruik de hellingsvergelijking om de helling te berekenen
Wat is Moleculariteit van een reactie?

Moleculariteit. De moleculaire aard van een reactie wordt gedefinieerd als het aantal moleculen of ionen dat deelneemt aan de snelheidsbepalende stap. Een mechanisme waarbij twee reagerende soorten combineren in de overgangstoestand van de snelheidsbepalende stap wordt bimoleculair genoemd
