
- Auteur Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:39.
- Laatst gewijzigd 2025-01-22 17:06.
Elke elementen uitstoot spectrum is onderscheidend omdat elk element heeft een verschillend set van elektronen energieniveaus. de emissie lijnen komen overeen met de verschillen tussen verschillende paren van de vele energieniveaus. De lijnen (fotonen) worden uitgezonden als elektronen van hogere energie-orbitalen naar lagere energieën vallen.
Trouwens, waarom produceren verschillende elementen verschillende aantallen spectraallijnen?
De frequenties zijn kenmerkend voor de eigenschappen van de kern en de nummers van elektronen verdeeld over de verscheidene "schelpen." Volgens de kwantummechanica is er een maximum aantal elektronen toegestaan in elke gebonden schil. Dit is waarom verschillende elementen hebben verschillende discrete emissiefrequenties.
Ten tweede, waarom zijn sommige spectraallijnen helderder dan andere? in waterstof spectrum , sommige spectraallijnen zijn helderder dan anderen afhankelijk van hun energieniveau. Deze heldere lijnen laten zien dat elektronen van een hoger energieniveau naar een lager energieniveau zijn gesprongen. Dus in waterstof spectrum sommige lijnen zijn helderder dan anderen.
Wat stellen de verschillende kleuren in een lijnenspectrum in dit opzicht voor. Waarom zijn de spectra voor elk element uniek?
elk element heeft zijn eigen uniek lijnenspectrum en wordt daarom de "vingerafdruk" voor een bepaald element . De spectra voor elk element zijn uniek omdat elk element verschillende aantallen elektronen bevat en dus verschillend energie niveau.
Waarom straalt elk element een andere kleur uit?
Verwarming een atoom wekt zijn elektronen op en ze springen naar hogere energieniveaus. Wanneer de elektronen terugkeren naar lagere energieniveaus, uitstoten energie in de vorm van licht. Elk element heeft een verschillend aantal elektronen en a verschillend reeks energieniveaus. Dus, elk element zendt uit zijn eigen set van kleuren.
Aanbevolen:
Waarom zijn de vochtige en droge adiabatische vervalpercentages verschillend?

Over het algemeen condenseert de waterdamp erin als een luchtpakket opstijgt en komt er warmte vrij. De opstijgende lucht koelt dus langzamer af naarmate deze stijgt; de natte adiabatische lapse rate zal in het algemeen minder negatief zijn dan de droge adiabatische lapse rate. Mist ontstaat wanneer vochtige lucht afkoelt en het vocht condenseert
Wat zijn de reagentia die nodig zijn voor PCR en wat is de functie van elk?

Er zijn vijf basisreagentia of ingrediënten die bij PCR worden gebruikt: matrijs-DNA, PCR-primers, nucleotiden, PCR-buffer en Taq-polymerase. Primers worden meestal in paren gebruikt en het DNA tussen de twee primers wordt geamplificeerd tijdens de PCR-reactie
Waarom zijn de ouder- en dochtercellen in mitose en meiose verschillend?

Uitleg: De belangrijkste verschillen tussen mitose en meiose treden op in meiose stadium I. Bij mitose hebben de dochtercellen hetzelfde aantal chromosomen als de oudercel, terwijl bij meiose de dochtercellen de helft van het aantal chromosomen hebben als de oudercel
Waarom is het absorptiespectrum voor chlorofyl a en het actiespectrum voor fotosynthese verschillend?
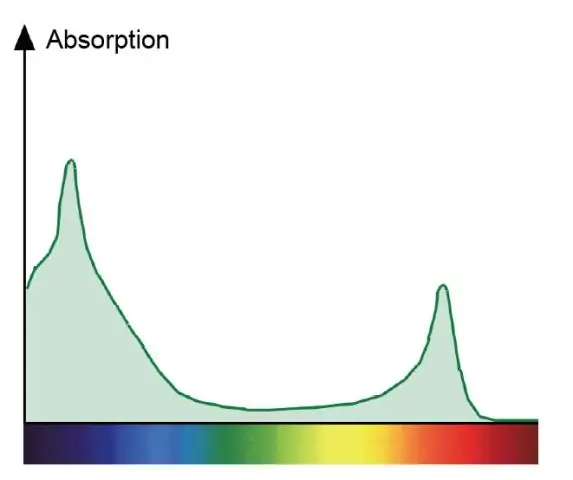
Een absorptiespectrum toont alle kleuren licht die een plant opneemt. Een actiespectrum toont alle kleuren licht die bij de fotosynthese worden gebruikt. Chlorofylen zijn de groene pigmenten die rood en blauw absorberen en direct deelnemen aan de fotosynthese
Hoe kan het verschil in helderheid van spectraallijnen zijn?

In het waterstofspectrum zijn sommige spectraallijnen helderder dan andere, afhankelijk van hun energieniveau. Wanneer het elektron uit een hogere baan springt, zal de energie die vrijkomt in het foton groter zijn en krijgen we een helderdere lijn. Dus in het waterstofspectrum zijn sommige lijnen helderder dan andere
