
- Auteur Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:39.
- Laatst gewijzigd 2025-01-22 17:06.
In het waterstofspectrum zijn sommige spectraallijnen zijn helderder dan anderen, afhankelijk van hun energieniveau. Wanneer een elektron uit een hogere baan springt, komt de energie die vrijkomt bij de foton zullen groter zijn, en we krijgen een helderder lijn. Dus in waterstofspectrum sommige lijnen zijn helderder dan anderen.
Ook om te weten is, welk element heeft de meeste spectraallijnen?
Mercurius: de sterkste lijn , bij 546 nm, geeft kwik een groenachtige kleur. Fig. 2. Bij verhitting in een elektrische ontladingsbuis is elk element produceert een uniek patroon van spectraal ` lijnen '.
Men kan zich ook afvragen, wat is verbreding van spectraallijnen? Lijnverbreding . spectroscopie. Lijnverbreding , in spectroscopie, de verspreiding over een grotere golflengte of frequentiebereik van absorptie lijnen (donker) of emissie lijnen (helder) in de straling die van een object wordt ontvangen.
Waarom zijn op deze manier spectraallijnen verschillend voor elk element?
Elke elementen uitstoot spectrum is onderscheidend omdat elk element heeft een verschillend set van elektronen energieniveaus. De lijnen (fotonen) worden uitgezonden als elektronen van hogere energie-orbitalen naar lagere energieën vallen.
Hoe herken je een spectraallijn?
Uitstoot lijnen worden gezien als gekleurd lijnen op een zwarte achtergrond. Absorptie lijnen worden gezien als zwart lijnen op een gekleurde achtergrond. De aanwezigheid van spectraallijnen wordt door de kwantummechanica verklaard in termen van de energieniveaus van atomen, ionen en moleculen.
Aanbevolen:
Hoe kan waterstofbinding tussen watermoleculen helpen bij het verklaren van het vermogen van water om grote hoeveelheden energie te absorberen voordat het verdampt?
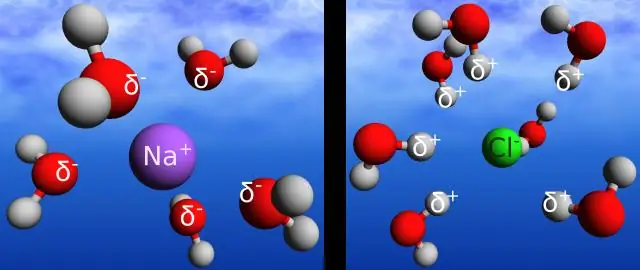
Door de waterstofbruggen in water kan het warmte-energie langzamer absorberen en afgeven dan veel andere stoffen. Temperatuur is een maat voor de beweging (kinetische energie) van moleculen. Naarmate de beweging toeneemt, is de energie hoger en dus de temperatuur hoger
Hoe heet de helderheid van een kleur?

Helderheid is de relatieve lichtheid of duisternis van een bepaalde kleur, van zwart (geen helderheid) tot wit (volledige helderheid). Helderheid wordt in sommige contexten ook wel Lichtheid genoemd, met name in SQL-query's
Wat is het verschil tussen energiebesparing en het principe van het behoud van energie?

De calorische theorie beweerde dat warmte niet kan worden gecreëerd of vernietigd, terwijl behoud van energie het tegenovergestelde principe inhoudt dat warmte en mechanische arbeid uitwisselbaar zijn
Welke golfachtige eigenschap van licht zorgt ervoor dat het van richting verandert wanneer het van het ene medium naar het andere gaat?

breking Wat dit betreft, waarom veranderen golven van richting wanneer ze van het ene materiaal naar het andere reizen? De reden dat de dichtheid het is verander richting is alsof de trillingen verschillende snelheden hebben en door de media gaan.
Waarom zijn spectraallijnen verschillend voor elk element?

Elk emissiespectrum van elk element is verschillend omdat elk element een andere reeks elektronenenergieniveaus heeft. De emissielijnen komen overeen met de verschillen tussen verschillende paren van de vele energieniveaus. De lijnen (fotonen) worden uitgezonden als elektronen van hogere energie-orbitalen naar lagere energieën vallen
