
- Auteur Miles Stephen [email protected].
- Public 2023-12-15 23:39.
- Laatst gewijzigd 2025-06-01 05:05.
Arrhenius Vergelijking : ln k = -Ea/R (1/T) + ln (A)<----- dit is de y = mx + b vorm van de vergelijking , maar ik heb moeite om te begrijpen hoe dit op te lossen. ln k = - 0.0008313/8.314 J/mol K (1/298 K ) + ln (-0.8794) <---- dit is hoe ik de cijfers heb ingesteld, maar ik denk niet dat het juist is
Hiervan, wat is Ln K in de chemie?
lnk = ln (Ae−Ea/RT)= ln A+ ln (e−Ea/RT) lnk = ln A+−EaRT=(−EaR)(1T)+ ln A. wat de vergelijking is van een rechte lijn waarvan de helling -Ea /R is. Dit biedt een eenvoudige manier om de activeringsenergie te bepalen uit waarden van k waargenomen bij verschillende temperaturen, door plotten lnk als functie van 1/T.
Wat is verder de snelheidsconstante k? De snelheidsconstante , k , is een evenredigheid constante die de relatie aangeeft tussen de molaire concentratie van reactanten en de tarief van een chemische reactie.
Mensen vragen ook, wat is de formule voor activeringsenergie?
Activeringsenergie bepalen. Merk op dat wanneer de Arrhenius-vergelijking wordt herschikt zoals hierboven, het een lineaire vergelijking is met de vorm y = mx + b; y is ln(k), x is 1/T, en m is -Eeen/R. De activeringsenergie voor de reactie kan worden bepaald door het vinden van de helling van de lijn.
Wat zijn de eenheden voor snelheidsconstante k?
De eenheden van k hangt af van de volgorde van de reactie, maar de eenheden zijn nooit Newton per meter. Als voorbeeld, voor een eerste orde reactie, k heeft de eenheden van 1/s en voor een tweede orde reactie, eenheden van 1/M.s.
Aanbevolen:
Hoe bereken je de standaarddeviatie van PMP?

De formule die in de PMBOK voor standaarddeviatie wordt gebruikt, is eenvoudig. Het is gewoon (P-O)/6. Dat is de pessimistische schatting van de activiteit minus de optimistische schatting van de activiteit gedeeld door zes. Het probleem is dat deze vorm op geen enkele manier een maat voor standaarddeviatie oplevert
Hoe bereken je de omtrek van de aarde op haar breedtegraad?

De omtrek van een cirkel is gelijk aan 2πr waarbij r de straal is. Op aarde is de omtrek van de bol op een bepaalde breedtegraad 2πr(cos θ) waarbij θ is de breedtegraad en r is de straal van de aarde op de evenaar
Hoe bereken je frequentie uit frequentie en procent?
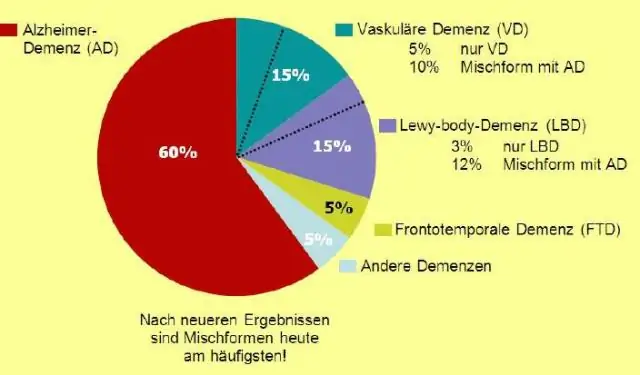
Om dit te doen, deelt u de frequentie door het totaal aantal resultaten en vermenigvuldigt u met 100. In dit geval is de frequentie van de eerste rij 1 en het totale aantal resultaten is 10. Het percentage zou dan 10,0 zijn. De laatste kolom is Cumulatief percentage
Hoe bereken je potentiële daling in een circuit?
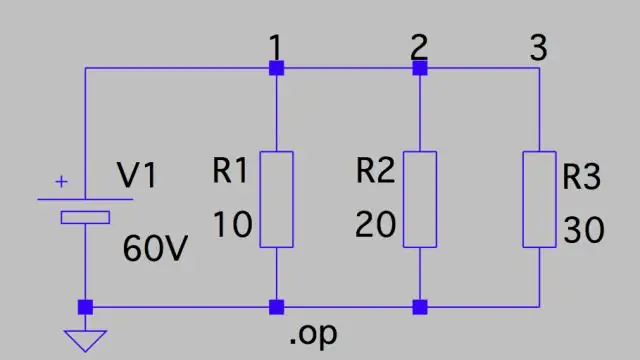
Spanningsval: parallel circuit Dit betekent dat de spanningsval over elk circuit slechts de totale spanning van het circuit is, gedeeld door het aantal weerstanden in het circuit, of 24 V/3 = 8 V
Hoe bereken je hoe ver een object zal reizen?

De afgelegde horizontale afstand kan worden uitgedrukt als x = Vx * t, waarbij t de tijd is. Verticale afstand tot de grond wordt beschreven door de formule y = h + Vy * t – g * t² / 2, waarbij g de zwaartekrachtversnelling is
