
- Auteur Miles Stephen [email protected].
- Public 2023-12-15 23:39.
- Laatst gewijzigd 2025-01-22 17:06.
In het voorbeeld, één molecuul van HCl produceert één waterstofion. Vermenigvuldig de zuurconcentratie met het aantal geproduceerde waterstofionen om de concentratie [H+] te berekenen. Als bijvoorbeeld de concentratie van HCL in de oplossing 0,02 molair is, dan is de concentratie waterstofionen 0,02 x 1 = 0,02 molair.
Wat is dan de H+ van HCl?
Omdat het een sterk zuur is, kunnen we aannemen dat: HCl dissocieert (ioniseert) volledig in water. Bovendien, aangezien één molecuul van HCl levert een op [ H+ ], is de equivalente massa gelijk aan de molecuulmassa. Daarom een éénmolaire oplossing van HCl (één molecuulmassa per liter), geeft een één molaire oplossing van [ H+ ].
Je kunt je ook afvragen, hoe bereken je H+ uit pH? De pH van een oplossing is gelijk aan de logaritme met grondtal 10 van de H+ concentratie, vermenigvuldigd met -1. Als je de kent pH van een wateroplossing, kunt u deze gebruiken formule omgekeerd om de antilogaritme te vinden en berekenen de H+ concentratie in die oplossing. Wetenschappers gebruiken pH om te meten hoe zuur of basisch water is.
Hierin, is H+ hetzelfde als HCl?
Zoutzuur ( HCl ) splitst in waterstofionen (H+) en chloride-ionen (Cl-). Extra H+ betekent zuuroplossing (geen gelijke delen meer).
Is HCl een sterk zuur?
EEN sterk zuur is een zuur die volledig geïoniseerd is in een waterige oplossing. Waterstofchloride ( HCl ) ioniseert volledig in waterstofionen en chloride-ionen in water. Een zwakke zuur is een zuur dat slechts in geringe mate ioniseert in een waterige oplossing. Omdat HCl is een sterk zuur , de geconjugeerde base (Cl−) is zeer zwak.
Aanbevolen:
Hoe vind je orthogonale banen van de familie van krommen?
Het algoritme omvat de volgende stappen: Construeer de differentiaalvergelijking G(x,y,y′)=0 voor de gegeven familie van krommen g(x,y)=C. Vervang y′ door (−1y′) in deze differentiaalvergelijking. Los de nieuwe differentiaalvergelijking op om de algebraïsche vergelijking van de familie van orthogonale banen f(x,y)=C te bepalen
Hoe vind je de lengte van een sector van een cirkel?

Een centrale hoek die wordt ingesloten door een grote boog heeft een maat groter dan 180°. De formule voor de booglengte wordt gebruikt om de lengte van een boog van een cirkel te vinden; l=rθ l = r θ, waarbij θ staat in radialen. Sectorgebied wordt gevonden A=12θr2 A = 1 2 θ r 2, waarbij θ is in radialen
Hoe vind je de waarde van cosinus van een driehoek?

In elke rechthoekige driehoek is de cosinus van een hoek de lengte van de aangrenzende zijde (A) gedeeld door de lengte van de hypotenusa (H). In een formule wordt het gewoon geschreven als 'cos'. Vaak herinnerd als 'CAH' - wat betekent dat cosinus aangrenzend is boven hypotenusa
Hoe vind je de vergelijking van de raaklijn van een afgeleide?

1) Zoek de eerste afgeleide van f(x). 2) Vul de xwaarde van het aangegeven punt in f '(x) om de helling bij x te vinden. 3) Steek de x-waarde in f(x) om de y-coördinaat van het raakpunt te vinden. 4) Combineer de helling uit stap 2 en punt uit stap 3 met behulp van de punt-hellingformule om de vergelijking voor de raaklijn te vinden
Hoe vind je de tegenovergestelde zijde van een driehoek met behulp van Pythagoras?
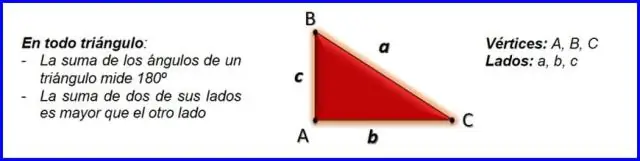
Rechte driehoeken en de stelling van Pythagoras De stelling van Pythagoras, a2+b2=c2, a 2 + b 2 = c 2, kan worden gebruikt om de lengte van elke zijde van een rechthoekige driehoek te bepalen. De zijde tegenover de rechte hoek wordt de hypotenusa genoemd (zijde c in de figuur)
